Video Overlay Titlle
Video Overlay description
Questo sito è dedicato a personale sanitario qualificato, coinvolto nella gestione del carcinoma gastrico o della giunzione gastroesofagea.
NON SONO UN OPERATORE SANITARIO MA DESIDERO MAGGIORI INFORMAZIONI SUI TUMORI GASTRICI/DELLA GIUNZIONE GASTRO-ESOFAGEA
Perché utilizzare gli anticorpi CLDN18 per rilevare CLDN18.2 nei campioni di tumore G/GGE?
Gli anticorpi CLDN18 possono identificare entrambe le isoforme principali: CLDN18.1 e CLDN18.2. Ma quando si valuta il tessuto tumorale G/GGE, la colorazione osservata riflette l'espressione di CLDN18.2 per i seguenti motivi:2
Preparazione del campione e fase preanalitica
La manipolazione e la preparazione adeguate dei campioni sono essenziali per garantire l'accuratezza dei risultati dei test con biomarker.1
Takeshi Kuwata, MD, PhD

Le linee guida raccomandano una manutenzione giornaliera del processore di tessuti secondo le raccomandazioni del produttore e una rigorosa manutenzione della qualità dei fluidi del processore, compresi il pH/purezza della formalina e la contaminazione dell'acqua da parte degli alcoli.1
Il tempo di ischemia fredda deve essere limitato a ≤60 minuti, secondo le attuali linee guida.1
Il CAP PPMPT fornisce raccomandazioni relative alle dimensioni e alla durata del processo di fissazione del campione.1
Il tessuto deve essere completamente immerso nel fissativo
Garantire un rapporto volume del fissativo/massa tissutale non inferiore a 4:1, con un rapporto ottimale di 10:1
La paraffina deve essere sciolta a temperatura <60°C
Come parte della stabilizzazione, il tessuto deve essere fissato in formalina neutra tamponata con fosfato al 10% (pH 7,0) per almeno 6 ore e non più di 24-36 ore
Se il tessuto ha un elevato contenuto di grassi, la fissazione può richiedere fino a 48 ore
È importante ottimizzare le variabili pre-analitiche per ridurre al minimo gli artefatti di colorazione, che possono interferire con un calcolo accurato del punteggio.
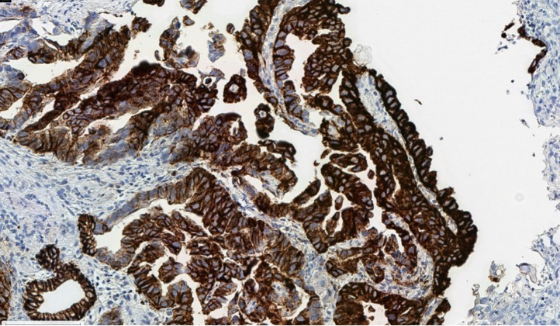
Blush citoplasmatico dovuto a una fissazione non ottimale, che può interferire con un'accurata classificazione delle membrane.
I tessuti trattati con processi di routine, fissati in formalina e inclusi in paraffina (formalin-fixed, paraffin-embedded, FFPE) sono adeguati all'utilizzo con i test IHC
I campioni che sono aspirati con ago fine (FNA), campioni citologici o lesioni ossee metastatiche non sono idonei per la colorazione della CLDN18.
Le sezioni di tessuto possono essere tagliate a 3-6 µm*
Prima della colorazione, i vetrini tagliati devono essere asciugati completamente a temperatura ambiente (asciugatura all'aria) oppure mediante essiccazione in forno a 60°C per 60 minuti*.
Per garantire l'integrità dei campioni, le aree di stoccaggio devono essere:

Sono disponibili numerosi test, anticorpi e piattaforme per la valutazione dell'espressione di CLDN18.2. I test e gli anticorpi selezionati includono il test IVD di Classe I VENTANA CLDN18 (43-14A), l'anticorpo LSBio PathPlus™ CLDN18 e l'anticorpo Novus Biologicals Claudin-18. Le opzioni per le piattaforme possono includere BenchMark ULTRA, Dako Autostainer e Leica Bond.4
L'elenco di anticorpi/test e piattaforme non è esaustivo e i test sopra menzionati non sono strumenti diagnostici complementari approvati da FDA. Si prega di utilizzare il test appropriato per guidare il processo decisionale clinico.
VENTANA CLDN18
(43-14A) IVD AssayScopri di più
LSBio PathPlus
CLDN18 AntibodyScopri di più
Abcam Recombinant Anti-Claudin 18 antibody (43-14A)Scopri di più
Christoph Röcken, MD
È essenziale effettuare controlli appropriati per il rilevamento di CLDN18.2 nei campioni di tumore G/GGE. Di seguito alcuni punti chiave sulla loro selezione e utilizzo.2,5
Le linee guida raccomandano che i laboratori convalidino e/o verifichino i test immunoistochimici prima di metterli in servizio clinico e che includano tessuti positivi, negativi e borderline, che riflettano l'uso previsto del test.5
In uno studio per valutare la riproducibilità e la comparabilità di tre anticorpi CLDN18 e piattaforme di colorazione IHC in una coorte di 27 laboratori a livello internazionale:4,*,†
* Gli anticorpi in studio comprendevano il test IVD di classe I VENTANA CLDN18 (43-14A) di Roche Tissue Diagnostics, l'anticorpo PathPlus™ CLDN18 di LSBio e l'anticorpo Claudin-18 di Novus Biologicals. Le piattaforme comprendevano BenchMark ULTRA, Dako Autostainer e Leica Bond.4
† Gli score di riferimento di consenso di tutti gli anticorpi per ciascun campione sono stati determinati da una revisione patologica centralizzata. La positività a CLDN18.2 è stata definita con una soglia pari a ≥75% di cellule tumorali che esprimevano CLDN18 di membrana con intensità di colorazione da moderata a forte (≥2+). Di conseguenza, ai patologi partecipanti è stato richiesto di presentare un giudizio binario di positività/negatività nonché una stima della percentuale di cellule colorate. I punteggi IHC inviati dal laboratorio sono stati confrontati con il punteggio di consenso di riferimento e considerati discordanti se il risultato binario positivo/negativo differiva. È stata eseguita un'analisi statistica per il confronto ed è stato applicato un criterio di accettazione dell'85% (≥0,85).4
CAP PPMPT, College of American Pathologists Preanalytics for Precision Medicine Project Team; CLDN, claudina; CLDN18.1, claudina 18 isoforma 1; CLDN18.2, claudina 18 isoforma 2; FDA, Food and Drug Administration degli Stati Uniti; G/GGE (G/GEJ), gastrico/della giunzione gastro-esofagea (gastric/gastroesophageal junction); IHC, immunoistochimica; IVD, diagnostica in vitro.

Bibliografia: 1. Compton CC, Robb JA, Anderson MW, et al. Preanalytics and precision pathology: pathology practices to ensure molecular integrity of cancer patient biospecimens for precision medicine. Arch Pathol Lab Med 2019;143(11):1346-63. 2. Ventana CLDN18 (43-14A) assay [package insert]. Mannheim, Germany: Roche Diagnostics GmbH. 3. Sahin U, Koslowski M, Dhaene K, et al. Claudin-18 splice variant 2 is a pan-cancer target suitable for therapeutic antibody development. Clin Cancer Res 2008;14(23):7624-34. 4. Jasani B, Taniere P, Schildhaus HU, et al. Global ring study to investigate the comparability of total assay performance of commercial claudin 18 antibodies for evaluation in gastric cancer. Lab Invest 2024;104(1):100284.5. College of American Pathologists. IHC assays—New evidence-based guideline for analytic validation (04-01-2004). https://documents.cap.org/documents/ihc-validation-webinar-handout.pdf. Accessed 03-30-2023. 6. ESMO Gastric Cancer Living Guidelines (07-2023). https://www.esmo.org/living-guidelines/esmo-gastric-cancer-living-guideline/diagnosis-pathology-and-molecular-biology/article/diagnosis-pathology-and-molecular-biology. Accessed 09-07-2023. 7. Piening B, Bapat B, Weerasinghe RK, et al. Improved outcomes from reflex comprehensive genomic profiling-guided precision therapeutic selection across a major US healthcare system [Abstract 6622]. J Clin Oncol 2023;41(Suppl 16).